sábado, 23 de mayo de 2009
ojo...
La teoría atómica de la materia define los estados, o fases, de acuerdo al orden que implican. Las moléculas tienen una cierta libertad de movimientos en el espacio. Estos grados de libertad microscópicos están asociados con el concepto de orden macroscópico. Las partículas de un gas no tiene un orden espacial macroscópico, sus moléculas se mueven aleatoriamente, y sólo están limitadas por las paredes del recipiente que lo contiene.
Se han desarrollado leyes empíricas que relacionan las variables macroscópicas. En los gases ideales, estas variables incluyen la presión (p), el volumen (V) y la temperatura (T). La ley de Boyle-Mariotte afirma que el volumen de un gas a temperatura constante es inversamente proporcional a la presión.
La ley de Charles y Gay-Lussac afirma que el volumen de un gas a presión constante es directamente proporcional a la temperatura absoluta. La combinación de estas dos leyes proporciona la ley de los gases ideales pV = nRT (n es el número de moles), también llamada ecuación de estado del gas ideal.
La constante R, es una constante universal cuyo descubrimiento fue una piedra angular de la ciencia moderna.
La constante R
Constante de los gases, constante R de la ecuación de los gases ideales o perfectos. Es una constante universal independiente de la especie química en estudio. Su valor numérico en el Sistema Internacional de unidades es R = 8,3144 J•mol-1•K-1. Otros valores de R utilizados en distintas unidades son R = 0,082 atm•l•mol-1•K-1, y R = 1,99 cal•mol-1•K-1.
Para un gas ideal, la presión, p, el volumen, V, y la temperatura absoluta, T, se relacionan por la ecuación
donde n es el número de moles de gas y R la constante de los gases. Esta ecuación recibe el nombre de ecuación de estado de los gases ideales o perfectos porque conocidas dos de las tres variables, se puede determinar la tercera. No obstante, esta ecuación es una buena aproximación para todos los gases reales a baja presión.
La constante k, llamada constante de Boltzmann, se puede definir como la constante de los gases por molécula, es decir, como el cociente entre la constante de los gases, R, y la constante de Avogadro, NA. Su valor numérico es 1,38•10-23 J•K-1.
La ley de Boyle-Mariotte, descubierta a mediados del siglo XVII, afirma que el volumen de un gas varía inversamente con la presión si se mantiene constante la temperatura. La ley de Charles y Gay-Lussac, formulada alrededor de un siglo después, afirma que el volumen de un gas es directamente proporcional a su temperatura absoluta si la presión se mantiene constante.
© Microsoft Corporation. Reservados todos los derechos.
Biblioteca de Consulta Microsoft ® Encarta ® 2005. © 1993-2004 Microsoft Corporation. Reservados todos los derechos.
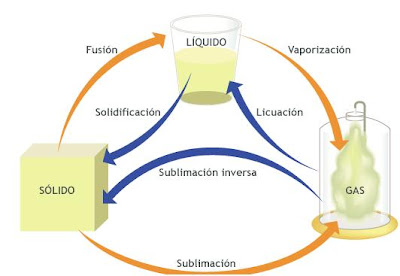
Diferencias entre...
- El gas real es aquel que verdaderamente existe y sobre el cual se puede observar su comportamiento y sus características son contrarias a las de los gases ideales, como: no tener las moléculas perfectamente esféricas, si ocurre interacciones moleculares y los choques moleculares no son elásticos.
- El gas ideal es aquel estado hipotético sobre el cual se aplican leyes formuladas y se obtienen resultados matemáticos muy exactos. Estos gases presentan moléculas perfectamente esféricas, no existe interacción molecular, los choques moleculares son elásticos y donde el volumen del recipiente que contiene el gas es muy grande comparado con el volumen molecular.
viernes, 22 de mayo de 2009
Propiedades de los gases
Las partículas que forman los gases están unidas por fuerzas muy débiles. Debido a ello, los gases carecen de forma y volumen propios, adoptan la forma y tienden a ocupar todo el volumen del recipiente que los contiene.
Los gases pueden comprimirse y expandirse (los líquidos y sólidos no). Comprimiendo o enfriando un gas, éste puede pasar al estado líquido, como sucede con el gas licuado que contienen las bombonas de butano.
Los gases están compuestos por moléculas separadas entre sí pero en constante movimiento. Se reconocen como fluidos porque se desplazan con facilidad debido a que no presentan una estructura compacta y sus moléculas tienen libertad de movimiento. La distancia de las moléculas de un gas varía con la temperatura y la presión a las cuales se sometan:
Presión de los gases: las moléculas de un gas chocan entre sí y con las paredes del recipiente. Así ejercen presión sobre cualquier superficie con el cual entren en contacto. Por ejemplo: la atmósfera ejerce presión sobre la Tierra y sobre todos los cuerpos que sobre ella se encuentran, ésta presión depende de la cantidad de gases presentes en la atmósfera; la mayor presión atmosférica se presenta al nivel del mar y va disminuyendo con la altura. La presión atmosférica se mide con el barómetro, cuyo invento se debe a Evangelista Torricelli (1608-1647).
Temperatura de los gases: la temperatura es una medida del promedio de energía cinética de las moléculas de un cuerpo, en un gas esta energía es fija a una temperatura dada.
Si al inflar un globo, no paramos de soplar, llegará un momento en que la presión sea tan grande que lo reviente, expandiéndose el aire de su interior. Otro ejemplo sería, si con un dedo tapamos la boca de una jeringuilla y apretamos su émbolo, éste avanzará pues el aire que hay en su interior se comprime, mientras que si tiene agua, nos resultará imposible mover el émbolo, ya que los líquidos no se comprimen.
INFORME
Informe sobre un programa disponible en la Web para la enseñanza de la química
ESTADO GASEOSO
* ¿Cumple con las expectativas de la persona que busca la información?
De acuerdo con la información presentada en este sitio web, se puede considerar que cumple con las expectativas porque no sólo se realiza la respectiva explicación de los temas relacionados con el estado gaseoso (como temperatura, presión, volumen, cantidad de gas, estados de agregación, leyes de Avogadro, Charles, Gay-Lussac, Graham, generalizada, teoría cinética), sino que presenta gráficos, ejercicios, laboratorios, biografías; lo cual hace que la página web sea una verdadera herramienta de trabajo y enseñanza para la química.
* ¿Es fácil el aprendizaje de la química en este sitio?
Considerando la facilidad de acceso, la presentación de los ejemplos y explicaciones, es posible establecer que el aprendizaje es apropiado y que se logra una buena comprensión de los contenidos que allí se presentan. Además es importante reconocer la calidad de los gráficos y animaciones presentadas, porque esto permite que el estudiante no sólo reconozca los conceptos más relevantes, sino que realmente pueda explicar en conjunto lo que compone el estudio del estado gaseoso. Además, es importante destacar que la presentación de las ecuaciones y ejercicios de tipo matemático son realmente visibles y el programa permite la opción de trabajo desde la calculadora que allí mismo se encuentra.
*¿Qué metodología se utiliza?
Primero que todo se explican algunas generalidades como los estados y agregación, temperatura, entre otros. Posteriormente, encontramos las respectivas leyes: Avogadro, Boyle, Charles, Gay-Lussac, gases ideales, ley generalizada. Luego se explica la teoría cinético-molecular que contiene a su vez temas como: teoría cinética, TCM y presión, TCM y temperatura, ley de Graham, gases reales. Finalmente encontramos lo que tiene que ver con ejercicios, laboratorios y biografías (Avogadro, Boyle, Charles, Gay-Lussac).
Para cada una de las secciones en las cuales se divide la página, encontramos una serie de gráficos, explicación teórica y los ejemplos correspondientes.
*¿Qué modelo didáctico se trabaja/pedagógico?
Al parecer, este sitio web se puede analizar desde el modelo constructivista de la enseñanza de las ciencias porque le permite ser una herramienta de aprendizaje para el estudiante, el cual trabaja de manera autónoma y a partir de lo que le presenta él puede ir construyendo sus propias percepciones y conclusiones del tema. Realmente es un mecanismo que permite que aquella persona que acceda a la información allí contenida, pueda elaborar conocimientos sobre el estado gaseoso. También se establece que con la ayuda de este instrumento informático, el grado de abstracción de la temática tiende a no ser tan elevado porque presenta gráficos y animaciones que le indican al estudiante el comportamiento de un gas de acuerdo con las condiciones que se presenten, con la propuesta de algún personaje o desde lo considerado como real o ideal. Debido a lo anterior, este sitio web presenta un componente creativo propio del constructivismo. Sin embargo, vale la pena aclarar que este no es la única herramienta informática diseñada para este tema, también es posible contar con videos, artículos, entre otros y que para lograr una adecuada comprensión o un aprendizaje significativo de los estudiantes se debe contar con un modelo mucho más elaborado y reflexivo, discutido con otros docentes e incluso con los estudiantes porque un sitio web se puede quedar corto en la enseñanza de cualquier temática a trabajar.
* ¿Dónde se encontró ese sitio Web?
La dirección de ese sitio web es la siguiente: http://www.educaplus.org/gases/
*¿Qué relación tiene con la química?
Por supuesto presenta una estrecha relación con la química porque este sitio web está diseñado precisamente para la enseñanza de la química, de un tema fundamental para la química que se enseña en el bachillerato como lo es el estado gaseoso. En esta página encontramos la explicación qua han dado los científicos sobre el comportamiento de los gases y la mejor forma de entenderlo es aplicando ese conocimiento por medio de ejemplos y gráficamente para su mejor comprensión.
jueves, 21 de mayo de 2009
Otras páginas para visitar sobre la química...
miércoles, 20 de mayo de 2009
Bibliografía
*Enciclopedia: Ciencia Visual; ED. Dorling Kindersley. 1997. páginas 18-22.
*Cárdenas, Fidel; Gélvez, Carlos. 1997. Química y ambiente 1. ED. Mc Graw Hill, páginas156-180.
* Biblioteca de Consulta Microsoft ® Encarta ® 2007. © 1993-2006 Microsoft Corporation. Reservados todos los derechos.
*www.cneq.unam.mx/cursos_diplomados/diplomados/medio_superior/ens_3/
* www.profesorenlinea.cl/fisica/GasesPropiedades.htm - 10k -
* www.educaplus.org/gases/index.html - 9k -
*Manco, Félix; Química general e inorgánica. 1997. ED. Igema; 4ª edición.
* www.isftic.mepsyd.es/w3/eos/MaterialesEducativos/mem2003/gases/ - 1k -
* www.sc.ehu.es/sbweb/fisica/estadistica/gasIdeal/gasIdeal.html - 15k -
* www.fing.edu.uy/if/cursos/fister/monitoreo/actividades/ej2mon.pdf -
* termodinamica.us.es/termica/transparencias/Leccion4.pdf –
*www.virtual.unal.edu.co/cursos/ingenieria/2001762/frames/gases.htm - 17k –
* www.visionlearning.com/library/module_viewer.php?mid=120&l=s - 29k –
* www.practiciencia.com.ar/cfisicas/materia/index.html - 30k -
*LOS ESTADOS DE LA MATERIA.www.youtube.com