sábado, 23 de mayo de 2009
ojo...
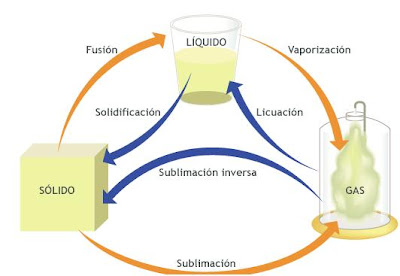
La teoría atómica de la materia define los estados, o fases, de acuerdo al orden que implican. Las moléculas tienen una cierta libertad de movimientos en el espacio. Estos grados de libertad microscópicos están asociados con el concepto de orden macroscópico. Las partículas de un gas no tiene un orden espacial macroscópico, sus moléculas se mueven aleatoriamente, y sólo están limitadas por las paredes del recipiente que lo contiene.
Se han desarrollado leyes empíricas que relacionan las variables macroscópicas. En los gases ideales, estas variables incluyen la presión (p), el volumen (V) y la temperatura (T). La ley de Boyle-Mariotte afirma que el volumen de un gas a temperatura constante es inversamente proporcional a la presión.
La ley de Charles y Gay-Lussac afirma que el volumen de un gas a presión constante es directamente proporcional a la temperatura absoluta. La combinación de estas dos leyes proporciona la ley de los gases ideales pV = nRT (n es el número de moles), también llamada ecuación de estado del gas ideal.
La constante R, es una constante universal cuyo descubrimiento fue una piedra angular de la ciencia moderna.
La constante R
Constante de los gases, constante R de la ecuación de los gases ideales o perfectos. Es una constante universal independiente de la especie química en estudio. Su valor numérico en el Sistema Internacional de unidades es R = 8,3144 J•mol-1•K-1. Otros valores de R utilizados en distintas unidades son R = 0,082 atm•l•mol-1•K-1, y R = 1,99 cal•mol-1•K-1.
Para un gas ideal, la presión, p, el volumen, V, y la temperatura absoluta, T, se relacionan por la ecuación
donde n es el número de moles de gas y R la constante de los gases. Esta ecuación recibe el nombre de ecuación de estado de los gases ideales o perfectos porque conocidas dos de las tres variables, se puede determinar la tercera. No obstante, esta ecuación es una buena aproximación para todos los gases reales a baja presión.
La constante k, llamada constante de Boltzmann, se puede definir como la constante de los gases por molécula, es decir, como el cociente entre la constante de los gases, R, y la constante de Avogadro, NA. Su valor numérico es 1,38•10-23 J•K-1.